Alteración de la Función Reproductiva Femenina por el Ejercicio Físico
José L Ferretti0
Resumen
Palabras Clave: menarca, amenorrea, mujer, regulación hormonal
En la última década, ha llamado crecientemente la atención acerca de la producción de alteraciones de la función reproductiva femenina derivadas de la práctica deportiva. Según Sanborn y Wagner (1), esta asociación se hizo evidente a partir del aumento enorme de la participación de la mujer en actividades atléticas en épocas recientes, pero en realidad se tiene conocimiento serio del fenómeno desde hace más de veinte años. Sin embargo, la falta de una definición standard de amenorrea secundaria, la heterogeneidad de las poblaciones estudiadas, y ciertos errores metodológicos, han oscurecido la descripción epidemiológica de ésta anomalía, y de hecho no se ha demostrado un mecanismo fisiológico que explique satisfactoriamente su producción. A continuación, se presentan algunas de sus características más concretas de esta alteración, de acuerdo con opiniones vertidas por expertos en los últimos cinco años. Los fenómenos más evidentes del trastorno consisten en una alteración del ritmo menstrual natural, definido técnicamente como una sucesión de 12 hemorragias anuales de 3 a 7 días de duración cada una, producidas cada 28 +/- 5 días. Pueden traducirse por una reducción de la cantidad del flujo hemorrágico (oligomenorrea), una disminución de la frecuencia de las menstruaciones (hipomenorrea), una alteración de la regularidad del cinco con hemorragias ocasionales entre los 3990 días (menstruaciones irregulares, también calificadas confusamente como oligomenorrea), una suspensión transitoria de los períodos por lapsos mayores a los 90 días, considerada la alteración principal, llamada amenorrea «secundaria», en contraste con la amenorrea «primaria», que es la falta absoluta de hemorragias menstruales, o sea, la ausencia de menarca más allá de los 16 años, y/o un retraso en la aparición de la primera menstruación. Estudios recientes han demostrado, por otra parte, que la incidencia de trastornos hormonales subyacentes supera en mucho a la de estas manifestaciones visibles; vale decir que, aún en las atletas con menstruaciones aparentemente normales (eumenorreicas o «cíclicas»), pueden darse alteraciones mas o menos importantes del delicado equilibrio hormonal que gobierna su función reproductora (2). Los estudios masivos de poblaciones, limitados a la detección de trastornos por simple interrogatorio, focalizaron su atención en la producción de amenorrea secundaria, definida técnicamente como la aparición de 3 o menos menstruaciones anuales, con una o ninguna en los últimos 3 a 6 meses, (o bien no más de una menstruación en los últimos 10 meses, o hemorragias irregulares separadas por no menos de 90 días), habiéndose dado ciclos regulares dentro de los primeros 18 meses de historia menstrual, y sin existir antecedentes de tratamiento con píldoras anticonceptivas por un mínimo de 6 meses antes del comienzo del trastorno. Las estadísticas disponibles refieren una alarmante frecuencia de alteraciones de este tipo con valores de hasta un 50 %, en general creciente con la intensidad o el volumen del entrenamiento, a veces hasta 80-90 % en casos extremos, pero también con una curiosa distribución dependiente del tipo de deporte practicado. La Figura 1 expone gráficamente este fenómeno, expresando cada cuántas mujeres normales que practican algunas clases de deportes puede esperarse que se encuentre una con alteraciones menstruales atribuibles a su entrenamiento, tomando como referencia la proporción natural de aparición de este tipo de trastornos en la población de mujeres normales sedentarias.
Llamativamente, la incidencia significativa de trastornos parece privativa de corredoras y bailarinas (en otros deportes el fenómeno es mucho menos trascendente), y dentro de cada disciplina ofrece una clara relación directa con la cantidad de ejercicio acumulado o con la exigencia física de la modalidad adoptada: las bailarinas profesionales sufren mucho más que las estudiantes; las corredoras de distancia más largas o de tipo cross-country están mucho más claramente expuestas que las que practican sobre distancias menores o a bajas velocidades de marcha, y otras deportistas de disciplinas cíclicas como las nadadoras o ciclistas parecen afectarse con una frecuencia comparable a la correspondiente a las menos exigidas de sus congéneres que practican carrera o danza. La relación entre la cantidad o la intensidad del entrenamiento y la producción de amenorrea atlética secundaria es bastante clara en algunos casos. (Warren (3) ha propuesto que la amenorrea se debería al «drenaje energético derivado del training»), pero no en otros, lo cual corrobora la discriminación de ciertas disciplinas como particularmente propensas. La Figura 2 muestra una neta dependencia de la incidencia de amenorrea con la cantidad semanal de ejercicio para mujeres corredoras, pero también señala que el fenómeno es indemostrable en nadadoras y ciclistas. Como no se dispone de información respecto del % del VO2 máximo al que efectuaron los correspondientes entrenamientos, es imposible establecer por ahora cuál de los parámetros del entrenamiento (volumen o intensidad) está, si acaso, relacionado con la amenorrea, pero las diferencias entre disciplinas son notables (1).
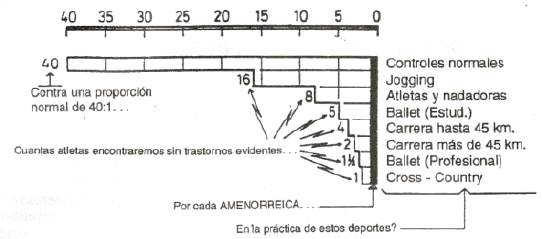
Figura 1
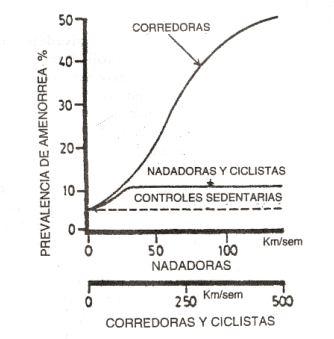
Figura 2
Dos características distintivas entre estos grupos de deportes de tan diversa propensión a la amenorrea parecen dignas de consideración; a) la tendencia a desarrollar mayor temperatura corporal central en corredoras y bailarinas que en nadadoras y ciclistas (en estas dos ú1timas especialidades regulan mejor su temperatura con el entrenamiento), hasta ahora poco investigada y que no discutiremos aquí, y b) la conformación cineantropométrica.
La llamativa similitud cineantropométrica entre la mayoría de las atletas víctimas del trastorno (longilíneas y magras), muchas con tan poco como 6 % de grasa corporal, e incluso menos, dio lugar a pensar que existiría una relación inversa entre el peso corporal (o, más exactamente, la masa grasa porcentual) y la propensión a la amenorrea.
La verificación experimental de esta correlación dio pie a la formulación de la llamada «hipótesis grasa» (1) de la etiología de la amenorrea atlética, según la cual, en las mujeres magras, la menor disposición de tejido adiposo reduciría significativamente su capacidad total de transformar químicamente moléculas de andrógenos (hormonas femeneizantes) y de estrógenos poco activos en otros más activos, y de actuar por consiguiente como una fuente de hormonas femeninas adicional a los ovarios. Esta proposición se vio avalada por el hecho que el comienzo y el mantenimiento de las menstruaciones se logran normalmente a un determinado peso crítico corporal, más exactamente que a una determinada edad cronológica. Esto es congruente con la observación de una reducción de la edad de la menarca en la población a lo largo del último siglo asociada a un mejor régimen alimenticio en los países civilizados, y con la producción de trastornos menstruales en pacientes con pérdida de peso y especialmente con anorexia nerviosa, reversibles con los respectivos tratamientos.
En efecto, es conocido que las irregularidades menstruales y la amenorrea son más comunes en atletas que pesan menos de 54 kg., o que perdieron más de 5-6 kg. luego de comenzar el entrenamiento, o en las que la grasa corporal cae por debajo del 22 % del peso o se reduce a la mitad con el entrenamiento, especialmente si los cambios se producen con rapidez. La Figura 3 ilustra el riesgo de producción de estos trastornos relativo al descenso de peso estudiado en bailarinas de ballet (4).
No faltan objeciones, sin embargo, a la referida «hipótesis grasa» (5); no es prudente confiar en las simples determinaciones de peso/altura para estudios pronósticos, porque lo que realmente parece participar en la correlación comentada es la composición corporal, dentro de la cual tendría también importancia la masa magra, dado que en los músculos tienen también lugar transformaciones de las hormonas sexuales. Los pliegues corporales y los métodos hidrostáticos suelen orientar correctamente, pero no siempre lo hacen con claridad. Algunos estudios arrojan datos contradictorios con los expuestos, y otros niegan la existencia de un «umbral de adiposidad» para el mantenimiento de las menstruaciones, aplicable a atletas en general.
Se ha señalado una relación estadística entre la producción de amenorrea atlética secundaria y la ocurrencia de menarca tardía (6), aunque no es clara la conexión fisiológica que pudiere existir entre ambos fenómenos, y ni siquiera está convenientemente aclarado si acaso no son las mujeres de menarca tardía las que, por alguna razón de tipo psicológico, eligen comenzar más temprano su entrenamiento en la vida.
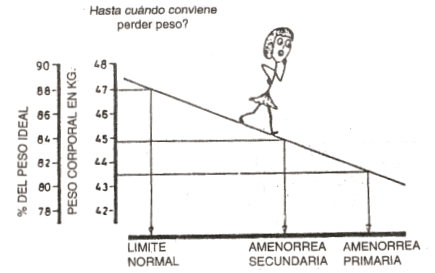
Figura 3
Sea como fuere, está bien establecido que el excesivo ejercicio en la infancia retrasa la menarca. Algunos estudios llegan hasta a cuantificar este efecto en aproximadamente 5 meses de retardo por cada año de anticipo del entrenamiento a la menarca, aunque es imposible eliminar la influencia de la intensidad de la práctica. La Figura 4 ilustra este fenómeno en forma aproximada. A este respecto, también se ha observado que un entrenamiento intenso en la infancia, aparte de retrasar la menarca, aumenta sustancialmente (hasta cuatro veces) la incidencia de la amenorrea atlética secundaria, con casos de ausencia completa de hemorragias por períodos de hasta seis meses. No es claro, sin embargo, que el sistema reproductor resulte alterado directamente por el ejercicio como única causa. Sanborn y Wagner señalan algunos factores intercurrentes posiblemente importantes en la etiología de la amenorrea atlética secundaria, entre ellos una historia de irregularidades menstruales previas (considerada el menor predictor del trastorno con una asociación tan alta como el 50 %); el «stress» psíquico (los tests psicométricos no arrojan resultados característicos, pero las amenorreicas suelen juzgar «más estresante» que las normales a un entrenamiento similar, y se evalúan subjetivamente más asociadas al «stress» derivado del ejercicio de su disciplina); la edad (la incidencia es muchísimo mayor entre las atletas menores de 30 que en las mayores); la dieta (algunos han detectado un consumo menor de proteínas en las atletas amenorreicas que en las normales, pero no está aclarada su asociación etiológica con el problema), y la «madurez hipotalámica» (así como la juventud predispone al trastorno, la menarca temprana, la regularidad menstrual y el embarazo previo protegen contra el mismo).
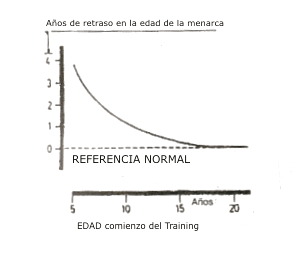
Figura 4
Es razonable proponer que la generación de alteraciones menstruales del tipo que nos ocupa pueda deberse a la asociación de más de una de las causas enumeradas en muchos casos. Sin embargo, aún mediante complicados análisis estadísticos de regresión múltiple, efectuados para detectar la influencia asociada de más de un factor en la producción de la amenorrea (5), sólo se ha conseguido explicar hasta ahora las causas de no más de 1/3 de las variaciones registradas de la historia menstrual, por lo que por el momento no se estima que la asociación causal juegue un rol etiológico importante.
Dada la conocida relación funcional entre la producción de la menstruación y el ciclismo hipotálamo-hipófiso-ovárico, el campo de investigación fisiopatológico sin duda más importante para la producción de la amenorrea atlética secundaria es el de la influencia del ejercicio físico sobre la secreción de hormonas sexuales. En este terreno, los hallazgos han sido más orientadores y más profundos que los que surgen de estudios epidemiológicos masivos por simple correlación de parámetros del entrenamiento con la historia menstrual, y han revelado trastornos adicionales subyacentes que afectan de manera diversa a la función sexual.
La Figura 5 pretende esquematizar en la forma más simple posible las interrelaciones funcionales que se conocen entre el hipotálamo, la hipófisis y el ovario en condiciones normales. La periodización de la producción de hormonas sexuales de la mujer está normalmente determinada por «golpes» o «pulsos» de secreción hipotalámica de la hormona GnRH que, según su frecuencia (representada en la figura por líneas interrumpidas a distintos intervalos), inducen la liberación de gonadotrofina folículo estimulante o FSH (baja frecuencia de pulsos) solamente, o también de gonadotrofina luteinizante o LH (alta frecuencia) por parte de la hipófisis (7). La FSH y la LH alcanzan al ovario por la circulación sanguínea y actúan a su turno sobre uno de los folículos ováricos (conjuntos estructurales constituidos por un óvulo y varias capas celulares envolventes, denominadas «zona granulosa» y « tecas») desde el comienzo de cada menstruación (día 1 del ciclo de 28). La FSH estimula la transformación de andrógenos a estrógenos (estradiol) en las células de la zona granulosa del folículo, y la LH estimula en las células de la denominada «teca folicular» la producción de los andrógenos que utilizan las células de la zona granulosa como materia prima. El estradiol producido y volcado a la sangre, a bajas concentraciones, modula a su vez la secreción de GnRH por el hipotalamo y de FSH por la hipófisis, para regular la formación de un folículo normal (mecanismo regulatorio de retroalimentación o de «feedback» negativo). Normalmente, el estradiol aumenta durante los primeros 14 días del ciclo menstrual (fase «folicular»), especialmente del día 7° al 14° con un importante pico en el último día.
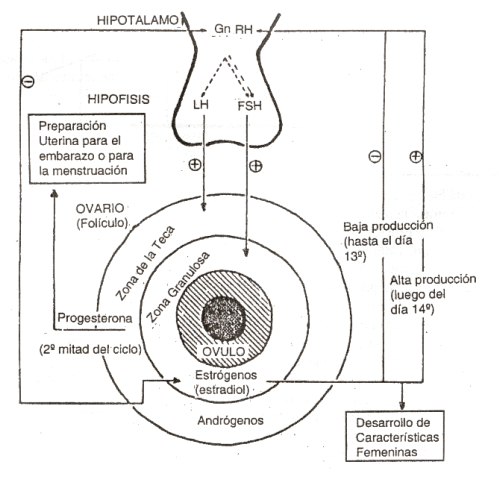
Figura 5
A esas altas concentraciones, el estradiol se convierte en un estimulante de la hipófisis (cambio de signo del feedback», de negativo a positivo), y aumenta bruscamente la secreción de FSH y LH. Esta última induce la ovulación (ruptura del folículo con expulsión del óvulo hacia las trompas para su eventual fecundación) al 14° día, y se inaugura con ella la segunda mitad del ciclo (días 1528, o fase «lútea»), durante la cual el folículo se transforma en cuerpo amarillo y produce estradiol y progesterona. Esta última hormona, característica de esta fase, aumenta constantemente estimulada por la hormona LH hasta la proximidad final del ciclo, en proporción directa con el grado de desarrollo folicular alcanzado en la fase anterior, favoreciendo el desarrollo de la mucosa uterina hasta hacerla apta para recibir al óvulo eventualmente fecundado (Figura 6). Si no ocurre la fecundación del óvulo producido, la progesterona decae hacia el final de la fase lútea y sobreviene el desprendimiento de la mucosa uterina con una hemorragia que constituye la menstruación.
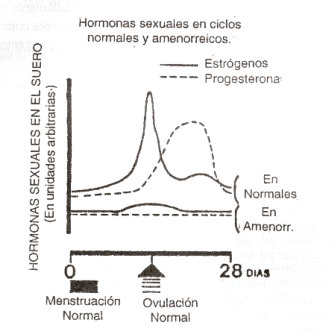
Figura 6
Una producción inadecuada de estrógenos (inhibidores de la producción de GnRH) de cualquier origen durante la fase folicular puede, por consiguiente, alterar la secreción y/o la normal relación que debe existir entre las concentraciones sanguíneas de FSH y LH y con ello acortar el desarrollo de la fase lútea, o anularla por completo, especialmente si el mal funcionamiento del sistema del «feedback» llega a ser tan grave como para impedir la ocurrencia de la ovulación (ciclo anovulatorio o monofísico). En ese caso, deja también de desarrollarse el correspondiente cuerpo amarillo productor de progesterona, alterándose la duración total del ciclo y con ella la regularidad del ritmo menstrual, pudiendo llegarse eventualmente a la supresión de la menstruación hasta el ciclo siguiente. En nadadoras normales, eumenorreicas, un régimen de entrenamiento extenuante de 2-4 horas diarias induce ciclos anovulatorios, con un funcionamiento defectuoso del cuerpo amarillo (5). Bajas concentraciones sanguíneas de FSH y altas de LH en la fase folicular son seguidas de una disminución de FSH, progesterona y estrógenos en la breve segunda fase (contada a partir del aumento de LH mencionado), que si no se pasa de 11 días (a veces dura sólo 5) afecta la fertilidad en mujeres adultas. Estos cambios suelen producirse ya a partir del primer entrenamiento intenso y pueden persistir por años si la práctica continúa, tal como fuera observado también en bailarinas (3).
En reposo, 1/3 de las corredoras eumenorreicas de larga distancia tienen ciclos normales, 1/3 tiene fase lútea corta, y el 1/3 restante directamente no ovula (5), siendo en general la duración de la segunda fase inversa a la intensidad del entrenamiento concominante (2) (Figura 7), o al volumen desarrollado durante la primera semana después de la menstruación anterior. Estos datos indican que, aparte de la producción de amenorrea en quienes la sufren, también es de esperar una cierta incidencia de trastornos de la fertilidad en atletas eumenorreicas, derivados de una inexistente o inadecuada fase lútea.
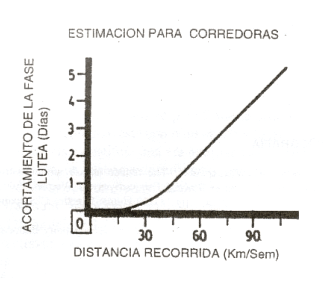
Figura 7
Las corredoras en general tienen, como acaba de verse, trastornos difusos del metabolismo de las hormones sexuales, pero las amenorreicas tienen específicamente un desarrollo insuficiente del folículo ovárico, con bajos valores de FSH que se mantienen invariables durante períodos de 23 a 40 días, y bajas concentraciones sanguíneas basales y pulsátiles de LH, con un total desbalance respecto de la FSH (1,5). El ejercicio intenso aumenta en forma aguda 1 a concentración sérica de estrógenos, progesterona y andrógenos, pero no la de las hormones hipofisiarias estimulantes. Esto hace pensar que los aumentos ocurren por efecto directo del ejercicio sobre la producción de hormonas sexuales en el ovario o en las suprarrenales (que también se afectan por «stress» psíquico y/o por alteraciones del ritmo de transformación y de eliminación de las hormones ováricas y/o suprarrenales en otros tejidos). El aumento de temperatura propio de la actividad física puede, también, aumentar la concentración sanguínea de ciertas moléculas (TeBG) que tienen la propiedad de acoplarse a las moléculas de hormonas, modificando su estructura y neutralizando por ello, su actividad (2). Por cualquiera de estos mecanismos se puede explicar la alteración del mecanismo de «feedback» regulatorio de la producción de hormonas por el hipotálamo y la hipófisis. Como la hipófisis suele responder en todos los casos a las pruebas de estimulación standard de laboratorio, pero no así el hipotálamo, es posible que la ausencia de ciclismo hipófiso-ovárico responsable de la amenorrea obedezca a una falla hipotalámica (1, 5). La reiteración de las sesiones de ejercicio puede producir, a este respecto, importantes efectos residuales cada vez, de forma que su repercusión sobre los ciclos menstruales puede resultar acumulativa. No todas las consecuencias de las alteraciones hormonales citadas son perjudiciales. Es posible que algunas de ellas tengan cierto valor adaptativo (1). Las corredoras de distancia tienen respuestas ventilatorias bajas a la hipoxia o a la hipercapnia (aumento del CO2 sanguíneo), favorables para la performance al reducir el trabajo inherente a la ventilación. La progesterona es un estimulante ventilatorio que afecta negativamente a los corredoras. Su disminución en las atletas amenorreicas podría resultarles beneficiosa, aunque no está bien demostrado que confiera ventajas concretas.
Todas las alteraciones mencionadas parecen ser transitorias (1). Los ciclos se reimplantan normalmente al suspender el entrenamiento, aunque no se sabe bien si lo hacen en forma permanente, o si son todos fértiles como en las eumenorreicas sanas, ni está tampoco claro por que mecanismo hormonal se produce la reversibilidad del estado. Esta circunstancia parece minimizarlos riesgos del entrenamiento a este respecto, por lo que no parece imperativo suspender la actividad de la atleta amenorreica. Sin embargo, debe advertirse que una falta prolongada de estrógenos puede también provocar alteraciones importantes en otro campo de interés sanitario: puede afectar la composición del material óseo, reduciendo su contenido en calcio y afectando su resistencia mecánica a la deformación y a la fractura (osteoporosis) en forma difícilmente recuperable. Por otra parte, la carencia prolongada de progesterona puede desproteger a la mucosa uterina (endometrio) contra la acción continuada de los estrógenos, aumentando su predisposición al desarrollo del cáncer genital (8). El control seriado de algunos indicadores endocrinológicos (concentración de gonadotrofinas, estrógenos, progesterona y andrógenos en el suero) y exámenes ginecológicos y esqueléticos frecuentes, cuya práctica se recomienda, pueden valorar adecuadamente la intensidad del trastorno productor de la amenorrea como uno de sus síntomas, y contribuir a su eventual tratamiento.
Referencias
1. Sanborn CF, Wagner WW (1988). The female athlete and menstrual irregularit. En: Sport Science Perspectives for Woman. Puhl J. Brown CH, Voy RO (eds.), pp. 111-30, Human Kinetics, Champaign
2. Bonen A, Keizer HA (1984). Athletic menstrual cycle irregularity: Endocrine responses to exercise and training. Phys. Sportsmed. 12 (8): 78-94
3. Warren MP (1980). The effects of exercise on pubertal progression and reproductive function in girls. J. Clin. Endocrinol. Metab. 51: 115057
4. Frisch RE, Wyshak G, Vincent L (1980). Delayed menarche and amenorrhea in ballet dancers. Delayed menarche and amenorrhea in ballet dancers
5. Loucks AB, Horvath SM (1985). Athletic amenorrhea: A review. Med. Sci. Sports Exercise (17) (1): 56-72
6. Malina MR, Spirduso WW, Tate C, Baylor AM (1978). Age at menarche and selected menstrual characteristics in athletes at different levels and different sports. Med. Sci. Sports 10: 218-22
7. Prior JC (1986). Hormonal mechanisms of reproductive function and hypothalamic adaptation to endurance training. En: The Menstrual Cycle and Physical Activity. Puhl JL, Brown CH (eds.) pp. 63-75. Human Kinetics, Champaign
8. Shangold MM (1986). How I manage exercise-related menstrual disturbances. Phys. Sportsmed. 14(3): 113-20
Cita Original
Reproducido del artículo original publicado en Actualizaciones Biosystem en Ciencias del Deporte, ABCD Vol. 1, Nro. 1, pp. 10-14, 1989 (Reedición). Reproducido con el permiso del autor y del Editor.
Cita en PubliCE
José L Ferretti (1997). Alteración de la Función Reproductiva Femenina por el Ejercicio Físico. .https://g-se.com/alteracion-de-la-funcion-reproductiva-femenina-por-el-ejercicio-fisico-301-sa-b57cfb27126f38
