Hormonas Lactogénicas y Doping: Una Hipótesis sobre el posible uso de la Prolactina como Sustancia Doping
Víctor M Cabrera Oliva1, Francisco E García Ucha1, Gema García Dafonte1, Mario J Granda Fraga11 Instituto de Medicina del Deporte, Boyeros, Ciudad de La Habana, Cuba.
Resumen
Palabras Clave: suplementación deportiva, hormonas hipofisiarias, alto rendimiento deportivo
En 1989 la Comisión Médica del Comité Olímpico Internacional (COI), introdujo un grupo de hormonas peptídicas y sus análogos como una nueva clase de sustancia doping. Dentro de este grupo se incluyeron la Gonadotropina Coriónica Humana (hCG), las gonadotropinas hipofisarias y sintéticas (Hormona Luteinizante, LH), la Corticotropina (ACTH), la Hormona de Crecimiento Humano (hGH), los Factores de Crecimiento Insulínicos (IGF-I, IGF-II), y todos los factores de liberación respectivos y sus análogos, la Eritropoyetina (EPO) y la Insulina (1).
Las primeras sospechas sobre el uso de la hGH como agente dopante en el deporte aparecieron durante los Campeonatos Mundiales de Natación, en 1998, cuando se encontraron ámpulas de Hormona de Crecimiento Recombinante (rhGH) en posesión de uno de los equipos participantes en las competencias y en el mismo año se descubrió una gran cantidad de rhGH y de Eritropoyetina (EPO) en poder de un equipo italiano durante el Tour de France.
Las condiciones que determinaron la introducción de la hGH como sustancia doping, fueron por una parte, la disponibilidad de esta hormona a precios relativamente bajos y fácil accesibilidad debido a su producción masiva mediante la tecnología de ADN recombinante, y por otra parte su capacidad probada de aumentar la masa magra de los deportistas en el fisicoculturismo y en la alterofilia y la seguridad en el uso del medicamento al disminuir las posibilidades de introducir algún tipo de infección en el organismo.
Los efectos anabólicos y lipolítico de la hGH se han demostrado en estudios en adultos con deficiencias en la síntesis de esta hormona. Se considera que una vez inyectada, la rhGH es prácticamente indetectable por los procedimientos disponibles en la actualidad, debido a su similitud con la hormona de origen hipofisario.
El registro del uso de hGH como sustancia de abuso en el deporte es prácticamente anecdótico, pues no se ha logrado establecer un método mediante el cual se pueda diferenciar que parte del contenido total de la hGH circulante en el plasma corresponde a las dosis suministradas en forma exógena, y cuál ha sido sintetizada por el propio organismo. Los pronósticos de poder establecer una determinación cuantitativa diferencial son pocos, debido a que la vida media de la rhGH en el plasma es sólo de 15-28 minutos, pero además, la secreción de hGH hipofisaria fluctúa, y depende de múltiples factores dentro de los cuales se encuentran el sueño, estado de nutrición, ejercicio, estrés emocional y otros.
En la actualidad el uso de muestras de orina para la determinación de las concentraciones de hormonas peptídicas, sólo ha resultado satisfactoria para la determinación de Gonadotropina Coriónica Humana (hCG) y Eritropoyetina, pero se espera obtener resultados igualmente satisfactorio para la hGH, sin embargo, la determinación de las concentraciones del resto de las hormonas peptídicas deben realizarse en muestras plasmáticas, lo cual representa un serio problema debido al carácter invasivo del procedimiento de muestreo.
La carta Internacional Olímpica contra el Dopaje en el Deporte en uno de los incisos del apéndice I plantea que “se debe estimular el desarrollo de investigaciones en el análisis bioquímico y farmacológico en los laboratorios de control de dopaje. Los nuevos datos deben ser circulados y los resultados publicados rápidamente…”. En este sentido, la sospecha debidamente sustentada sobre las posibilidades reales de que una sustancia determinada pudiera ser utilizada como agente dopante, establecería una barrera de contención para los investigadores inescrupulosos que utilizan el desarrollo de nuevas drogas para el dopaje, las cuales venden al mejor postor con el mayor afán de lucro.
El objetivo del presente trabajo de revisión fue establecer los criterios que nos han permitido plantear la hipótesis de que la Prolactina puede ser utilizada como sustancia doping.
Existe un grupo de hormonas con funciones fisiológicas y metabólicas bien definidas que se conocen como hormonas lactogénicas, el cual está compuesto por la Hormona de crecimiento (hGH), el Lactógeno Placentario (LP) y la Prolactina (Prl). La familia de las hormonas lactogénicas se originó por duplicación genética a partir de un gen ancestral común hace más de 400 millones de años (2).
Aunque hasta el presente sólo la hGH se ha estudiado como una sustancia con propiedades doping (3), otra hormona de esta propia familia, la Prolactina (Prl), que es similar a la hGH de acuerdo a sus propiedades estructurales, biológicas e inmunológicas, no ha sido investigada en este sentido o no ha llamado particularmente la atención de la comisión médica del COI.
Hasta el presente no existen referencias sobre la utilización de la Prolactina (Prl) como una sustancia doping, sin embargo, las posibilidades reales de manipular las concentraciones circulantes de esta hormona por vía medicamentosa y los marcados efectos fisiológicos y metabólicos de la misma, la convierten en una sustancia potencialmente capaz de ser utilizada como un medio de dopaje.
Al igual que ocurre con la hGH, la Prl puede ser producida por la tecnología del ADN recombinante, y el producto obtenido tiene una secuencia amino acídica y propiedades biológicas e inmunológicas idénticas a la de la hormona de origen hipofisario.
El gen que codifica para la Prl es único, y está localizado en el cromosoma 6, tiene un tamaño de 10 kb y está compuesto por 5 exónes y 4 intrones (4). La transcripción del gen de la Prl está regulado por dos regiones promotoras independientes, una región proximal que es específica para la forma hipofisaria de la hormona y una región que responde a la síntesis de la forma extrahipofisaria de la hormona (5). La Prl está compuesta por una cadena lineal de 199 aminoácidos formando tres asas mediante puentes disulfuros entre los residuos de cisteína (6). La Prl se caracteriza por presentar un marcado polimorfismo molecular. Además de la variante molecular de 22,5 kDa, que representa la mayor actividad hormonal circulante, se pueden encontrar en menor proporción las formas diméricas y poliméricas, glicosiladas, sulfatadas, desaminadas, escindidas, abiertas y fosforiladas (5). Estas variantes moleculares se pueden formar mediante transformaciones posttranslacionales, por ordenamiento alternativo de los ARN mensajeros, por procesamiento proteolítico y por combinación de las diferentes causas (6).
La Prl es una hormona paradójica, históricamente conocida como la hormona de la lactación, actualmente se conoce que la misma regula más funciones fisiológicas y bioquímicas que el resto de las hormonas hipofisarias en su conjunto. Se han documentado más de 300 funciones para esta hormona dentro de las cuales se encuentran las relacionadas con la reproducción, regulación de la presión osmótica, crecimiento y metamorfosis, sinergismo con los esteroides, angiogénesis y regulación de la función inmune (7).
Las concentraciones plasmáticas de Prl pueden variar de acuerdo a determinadas condiciones fisiológicas y patológicas como son la presencia de adenomas hipofisarios, tumores de origen renal, embarazo, sueño profundo, coito, estrés emocional, ejercicio fuerte y prolongado y la administración de determinados medicamentos y drogas dentro de los cuales se encuentran los neurolépticos y psicofármacos.
La administración del Factor Liberador de la Tiroptopina (TRH), y la Metoclopramida pueden incrementar en más de cien veces los niveles normalmente circulantes de Prl, con picos máximos de secreción apreciables a los 30 minutos y regreso a los niveles basales a los 90 minutos (8). Los efectos fisiológicos más marcados de los niveles elevados de Prl o hiperprolactinemia se observan en la función reproductiva. En la mujer la hiperprolactinemia es una causa frecuente de trastornos menstruales que van desde la amenorrea con o sin galactorrea hasta los sangramientos intermenstruales, anovulación e infertilidad, mientras que el en el hombre los signos más representativos son la presencia de azoospermia, infertilidad, disminución de la libido y ginecomastia (9).
Existe un solapamiento muy marcado entre las funciones biológicas de la Prl y la hGH, por lo cual se puede esperar que la elevación fisiológica normal o medicamentosa de los niveles circulantes de estas dos hormonas, produzcan resultados metabólicos o funcionales muy similares.
En la tabla I se muestra un estudio comparativo entre algunas propiedades estructurales, biológicas e inmunológicas de la Prolactina y la Hormona de Crecimiento.
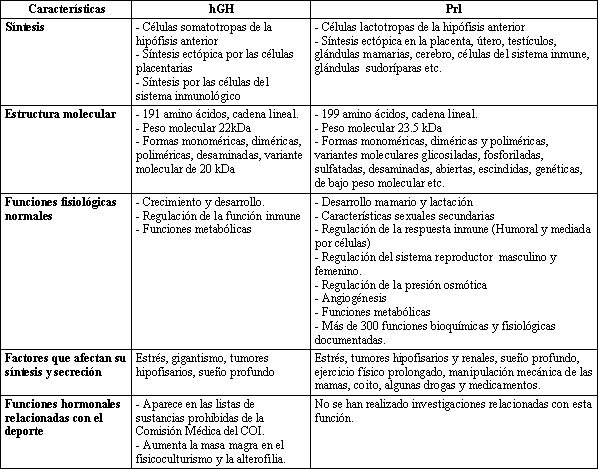
Tabla 1. Algunas características estructurales, biológicas e inmunológicas
de la hGH y la Prl.
La hGH, la Prl y el Lactógeno Placentario (LP) pueden producir efectos fisiológicos similares sobre determinados órganos, tejidos y células, como es la regulación de la liberación y el contenido de Insulina por los cultivos de las células Beta de los islotes de pancreáticos (10).
El efecto promotor del crecimiento estimulado por la hGH está mediado por dos factores de crecimientos, el IGF-I o Somatomedina C y el IGF-II (Figura 1)(11,12). Estos dos péptidos están representados por dos cadenas extendidas que contienen 67 y 70 residuos de amino ácidos respectivamente y se sintetizan en el hígado, riñones y órganos dianas periféricos.
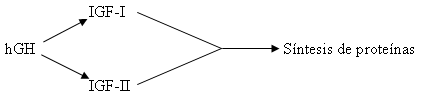
Figura 1. Mecanismo propuesto para la inducción de la proliferación celular
y síntesis de proteínas por la hGH mediante los factores de crecimiento IGF-I y
IGF-II.
Algunas investigaciones han confirmado que la Prl ovina estimula la expresión genética del factor de crecimiento IGF-I en el hígado (13), sin embargo, los estudios realizados por Billestrup y Cols. Demostraron que el efecto estimulatorio de la hGH, Prl y LP sobre la proliferación de las células Beta pancreáticas no está mediado por el IGF-I (14).
La etapa inicial en la cascada de eventos metabólicos mediados por hormonas, se caracteriza por la formación inicial de un complejo Hormona-Receptor (H-R), por esta razón la presencia de receptores específicos para una hormona en un tejido determinado, se asocia con una determinada función biológica.
Auque durante muchos años no se han podido relacionar claramente las funciones de la Prl con la expresión relativamente elevadas de sus receptores en el hígado, se ha demostrado que existe un número significativo de factores hepáticos que son activados por la Prl. Dentro de estos factores se encuentran la Proteína Cinasa C (PKC), Diacilglicerol, Proteína Cinasa Activada por Mitógenos (MAP) y el recambio del Fosfoinositol. La Prl induce varios genes de factores de crecimiento en el hígado, dentro de los cuales se encuentran el IGF-I, y otros genes reguladores como son la Ornitina Decarboxilasa (OD), c-myc, c-fos, c-jun y c-src. Aunque generalmente el IGF-I se asocia con la estimulación por hGH, pudieran existir situaciones metabólicas en las cuales este factor de crecimiento podría responder preferentemente a la Prl. La Prl induce el gen de la ODC y la proteína se activa en numerosos tejidos como son el corazón, músculos, riñones, gónadas, adrenales y próstata.
Se ha demostrado que la Prl afecta al metabolismo de los carbohidratos incluyendo las funciones hiperglicémicas/diabetogénicas en diferentes especies de vertebrados. La Prl tiene un efecto diferencial sobre las enzimas de la vía Embden-Meyerhoff y de la lanzadera de los fosfatos de hexosas en las células neurales y gliales de los monos machos. La Prl a concentraciones fisiológicas produce un aumento en cuatro veces de la activación de las enzimas glicógeno fosforilasa en los hepatocitos aislados (15).
La Prl tiene efectos directos sobre la función pancreática, aumentando la insulino-secreción (16, 17,), disminuyendo el umbral de glucosa para la insulino-secreción (18) y aumentando el sistema transportador 2 para la Glucocinasa y la glucosa (19).
Se ha informado la existencia de una acción directa de la Prl sobre la esteroidogénesis adrenal, la Prl aumenta los andrógenos adrenales Dehidroepiandrosterona (DHA), y el Sulfato de Dehidroepiandrosterona (DHAS), (20), así como el Cortisol y la Aldosterona (21).
El rol fisiológico de la Prl en los varones resultó una incógnita para los investigadores, debido a que se consideraba que la única función de la Prl era la regulación de la lactación y el desarrollo mamario en la hembra (4). Investigaciones posteriores dejaron claramente establecido que la Prl estimula la función testicular en muchos mamíferos. En las células de Leydig, la Prl está relacionada con el mantenimiento de la morfología celular (22), con el aumento del número de receptores para la LH (23, 24), aumento de la esteroidogénesis y la producción de andrógenos (24). En las células de Sertoli, la Prl aumenta el número de receptores para la Hormona Estimuladora de los Folículos (FSH), (25).
De acuerdo con los aspectos revisados anteriormente, se puede inferir que la elevación artificial de los niveles circulantes de Prl mediante medicamentos como la Metoclopramida, TRH, y otros dentro de los cuales se encuentran los neurolépticas, pueden inducir transformaciones en el metabolismo energético, lipídico, esteroidogénico y de los carbohidratos, que se pueden traducir en cambios anabólicos similares o de mayor intensidad que los producidos por algunas sustancias estimulantes registradas en las listas del COI.
Para detectar el uso fraudulento de la manipulación de las concentraciones endógenas de Prl como sustancia doping, no sería obligatoriamente necesario determinar las concentraciones plasmáticas de la hormona como es el caso de la hGH, sino que bastaría con determinar las concentraciones urinarias de los medicamentos o sus metabolitos utilizados para estimular la síntesis o liberación de la misma.
Debido a su similitud funcional, es de esperar que los efectos secundarios que produciría la elevación mantenida de los niveles circulantes de Prl sobre la salud de los deportistas, sean similares e incluso más complejos que los inducidos por la hGH.
Referencias
1. No Disponible (2004). Olimpic Movement Anti-Doping Code. Editon
2. Cooke NE, Coit D, Shine J, Baxter JD, JA Martial (1981). Human prolactin cDNA structural analysis and evolutionary comparissons. J Biol Chem 256:4007-4016
3. Kicman AT, DA Cowan (1992). Peptide hormones and sport: Misuse and detection. British Med Bull 48:496-517
4. Freemen ME, Kanicska B, Lerant A, G Nagy (2003). Prolactin: Structure, function, and regulation of secretion. Physiologuical Rev 80:1523-1631
5. Sinha YN (1995). Structural variants of prolactin: Occurrence and physiological significacance. Endocrine Rev 16:354-369
6. Ben-Jonathan N, Mershon JL, Allen DL, RW Steinmetz (1996). Extrapituitary prolactin: Distribution, Regulation, Functions and clinical aspects. Endocrine Rev 17:639-66
7. Berczi I (1992). The immunology of prolactin. Sem in Reprod Endocrinol 10:196-219
8. Goffin V, Nadine B, Phillipe T, PA Kelly (2002). The new biology of an old hormone. Ann Rev Physiol 64:47-67
9. Nielsen JH (1982). Efects of growth hormone, prolactin and placental lactogen on insulin content and release, and deoxyribonucleic acid synthesis in cultured pancreatic islets. Endocrinology 110:600-606
10. Murphy IJ, Tachiban K, Friesen HG (1988). Stimulation of hepatic insulin-like growth factor I gene expression by ovine prolactin: evidence for intrinsic somatogenic activity in the rat. Endocrinology 122:2027-2033
11. Billestrup N, JH Nuken (1991). The stimulatory efect of growth hormone, prolactin and placental lactogen on beta-cell proliferation is not mediated by insulin growth factor-I. Endocrinology 129:883-888
12. Villalba M, Zabala MT, Martinez-Serrano A, de la Calina A, Satrustegui J, JP Garcia-Ruiz (1991). Prolactin increases cytosolic free Calcium concenration in hepatocytes of lactating rats. Endocrinology 129:2857-2861
13. Sorenson RL, Brelje TC, Kegre OO, Marshal S, Anaya P, JD Sheridan (1987). Prolactin (in vitro) decreases the glucose stimulation threshold, enhances insuline secretion, and increases dye coupling among islet Beta cells. Endocrinology 121:1447-1453
14. Curry DL, Bernett LL, CH Li (1975). Dynamics of insulin release by perfused hamster(Mesocrisetus auratus) pancreases: effects of hypophysectomy, bovine and human growth hormone, and prolactin. J endocrinol 65:245-251
15. Sorenson RL, Johanson MG, Parso JA, JD Sherida (1987). Decrease glucosa stimulation threshold, enhanced insulin scretion, and increased Beta-cell coupling in islets of prolactin-treated rats. Pancreas 2:283-288
16. Kumaran B, Gunasekar PG, Aruldhas MM, P Gavindarajuly (1988). Role of prolactin on neural and glial celular enzymes involved in carbohydrate metabolism.I.Studies on inmaturesmale bonnet monkeys. Brain Res 450:325-333
17. Higuchi K, Nawata H, Maki T, Higashizima M, Kato K, H Ibayashi (1984). Prolactin has a direct effect on adrenal androgen secretion. J Clin Endocrinol Metab 59:714-718
18. Glasow A, Breidert M, Haidan A, Anderegg U, Kelly PA, S Bornstein (1996). Functional aspects of the effect of prolactin (Prl) on adrenal steroidogenesis and distribution of the prolactin receptor in the human adrenal glands. J Clin Endocrinol Metab 81:3103-3111
19. Nag, S, Sanyal S, Ghosh KK, NM Biswas (1981). Prolactin supression and spermatogenic developments in maturing rats. A quantitative study. Horm Res 15:72-77
20. Dombrowicz D, Sente B, Closset J, G Hennen (1992). Dose-dependent effects of human prolactin on the immature hypophysectomized rat testis. Endocrinology 130:695-700
21. Bole-Feysot C, Goffin V, Edery M, Binard N, PA Kelly (1998). Prolactin (Prl) and its receptor: actions, signal transduction pathwya and phenotypes observed in Prl receptor knockout mice. Endocrine Rev 19:225-268
22. Guillamot P, Talbone E, M Benahmed (1996). Sertoli cells as potencial targets of prolactin action in the testis. Mol Cell Endocrinol 122:199-206
Cita en PubliCE
Víctor M Cabrera Oliva, Francisco E García Ucha, Gema García Dafonte Mario J Granda Fraga (2004). Hormonas Lactogénicas y Doping: Una Hipótesis sobre el posible uso de la Prolactina como Sustancia Doping. .https://g-se.com/hormonas-lactogenicas-y-doping-una-hipotesis-sobre-el-posible-uso-de-la-prolactina-como-sustancia-doping-328-sa-W57cfb27134d6f
